- Text : Christiane Fux
- Lesedauer : 4 Minuten
Wissenschaftler um Betty Tijms vom Alzheimer Center Amsterdam analysierten die Zusammensetzung von mehr als 1000 Eiweißen (Proteinen) im Nervenwasser (Liquor) von 419 Alzheimer-Patientinnen und -Patienten. Zum Vergleich führten sie die gleiche Analyse bei 187 nicht erkrankten Personen durch.
Liquorproben lassen sich aus dem Wirbelkanal der Wirbelsäule gewinnen (Lumbalpunktion). Die Flüssigkeit dort steht im Austausch mit dem Nervenwasser des Gehirns. Die enthaltenen Eiweiße spiegeln daher die laufenden Prozesse im Gehirn wider – auch die krankhaften.
Fünf Subtypen von Alzheimer gefunden
Bei der Auswertung der Eiweißprofile in den Liquorproben klassifizierten die Forschenden fünf Unterformen von Alzheimer: Sie beruhen auf unterschiedlichen Varianten von Alzheimer-Risikogenen und betreffen unterschiedliche Großhirnregionen.
Zudem verlaufen sie unterschiedlich und gehen mit unterschiedlichen Überlebenszeiten für die Betroffenen einher. „Das unterstreicht ihre klinische Relevanz“, schreiben die Autorinnen und Autoren.
Typenspezifische Therapien
Dass der Diagnose Alzheimer offenbar so unterschiedliche Mechanismen zugrundeliegen können, könnte dazu beigetragen haben, dass klinische Medikamentenstudien bisher so häufig gescheitert sind. Die Entdeckung von Subtypen mit ihren spezifischen Mechanismen eröffnet jetzt die Möglichkeit, künftig gezielter nach Therapieansätzen für jede einzelne Alzheimerform zu suchen, statt wie bisher auf den einen großen Wurf zu hoffen, der allen hilft.
Die fünf neuen Subtypen von Alzheimer kennzeichnet das Forscherteam folgendermaßen:
Subtyp 1 (neuronale Hyperplastizität)
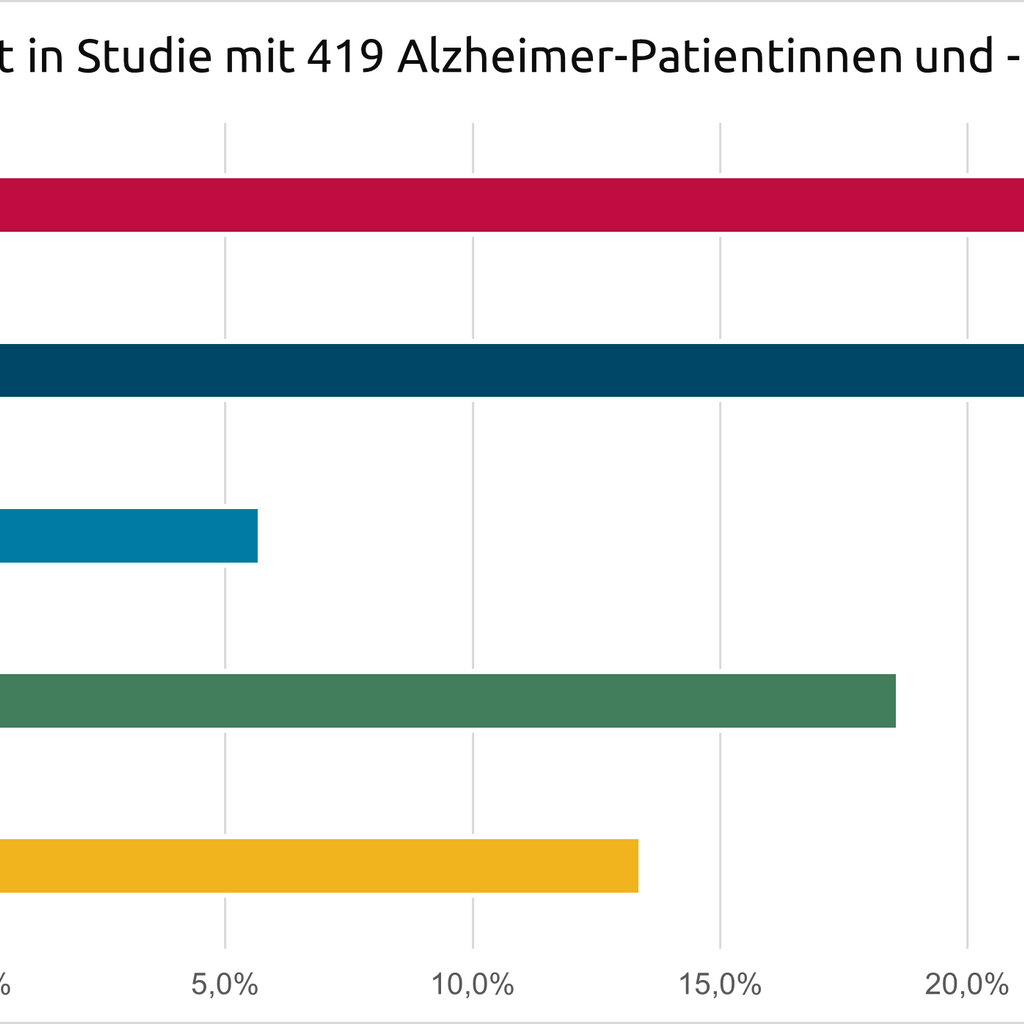
Er betraf mit 32 Prozent die meisten der untersuchten Patientinnen und Patienten. Die Forschenden sahen bei dieser Patientengruppe die höchste Konzentration an Proteinen verschiedener Hirnzelltypen. Den zugrundeliegenden Krankheitsmechanismus beschreiben sie als „neuronale Hyperplastizität“.
Der Begriff bezeichnet hier eine verstärkte Aktivierung der Nervenzellen (Neuronen) im Gehirn. Das widerspricht scheinbar dem Verständnis der Alzheimerdemenz, die ja gerade mit einem Verlust von Neuronen einhergeht.
Allerdings produzieren Neuronen mit erhöhter Aktivität mehr jener Proteine, die die typischen Alzheimerablagerungen bilden (Beta-Amyloid- und Tau-Proteine). Diese Ablagerungen verursachen, beschleunigen oder begleiten den Untergang der Nervenzellen. So genau weiß man das noch nicht. Jedenfalls wurden „hyperaktive Neuronen […] in der Nähe von Plaques beobachtet“, schreiben die Forschenden.
Zudem vermuten sie eine Störung der Funktion bestimmter Immunzellen (Mikroglia) als Krankheitstreiber beim Alzheimer-Subtyp 1. Die Aufgabe der Mikroglia ist es, schadhafte Zellen und Krankheitserreger im Gehirn zu beseitigen.
Im aktivierten Zustand bilden die Immunzellen normalerweise auch eine dichte Barriere um die Alzheimer-Plaques. So bilden sie einen Schutzwall für Nervenzellen.
Menschen mit dem Alzheimer-Subtyp 1 tragen häufig eine bestimmte Genvariante (TREM2) in sich, die die Aktivität der Mikroglia dämpft. „Dann sind die Amyloid-Plaques weniger kompakt“, schreiben die Forschenden. Die Folge: Zerstörerische Molekülkomplexe (toxische Oligomere) ragen aus der Mikrogliabarriere heraus und schädigen die benachbarten Nervenzellen.
Dem lässt sich künftig möglicherweise entgegenwirken: Medikamente, die auf die Aktivität von TREM2 einwirken, werden derzeit getestet.
Subtyp 2 (Störung der angeborenen Immunabwehr)
Der Alzheimer-Subtyp 2 betraf 29,6 Prozent der Patienten und Patientinnen in der Amsterdamer Studie. In ihrem Nervenwasser fanden sich vermehrt Proteine, die an der angeborenen Immunabwehr beteiligt sind.
Bei dieser Patientengruppe könnte demnach ein überaktives Immunsystem die Krankheitsprozesse befeuern. Tatsächlich fand das Team bei den Betroffenen Veränderungen an Genen, die das Immunsystem betreffen.
Möglicherweise könnten bei diesem Alzheimer-Subtyp Wirkstoffe helfen, die das Immunsystem bremsen.
Subtyp 3 (RNA-Dysregulation)
Der Subtyp 3 betraf mit 5,7 Prozent die kleinste Gruppe von Alzheimererkrankten. Bei ihnen fanden die Forschenden die höchsten Konzentrationen an Tau-Proteinen. Deren gehäuftes Auftreten ist neben Beta-Amyloid ein Hauptanzeichen für eine Alzheimererkrankung.
Die Forschenden vermuten, dass bei den Betroffenen im Rahmen der Proteinproduktion das Ablesen und die Übermittlung des genetischen Codes gestört sind. Dafür sind die verschiedenen Formen der RNA (Ribonukleinsäure) zuständig. Durch die Störung entstehen fehlerhafte Proteine.
Möglicherweise könnten Medikamente, die gezielt andocken (sogenannte Antisense-Medikamente), die Lesefehler eines Tages korrigieren.
Subtyp 4 (Funktionsstörung des Plexus choroideus)
Dieser Alzheimer-Subtyp betraf 18,6 Prozent der Teilnehmenden. Bei ihnen scheint vor allem eine Störung des sogenannten Plexus choroideus Ursprung des Alzheimer-Krankheitsprozesses zu sein.
Der Plexus choroideus ist jene Hirnstruktur, die das Hirnwasser produziert. Zudem sorgt sie dafür, dass nur bestimmte Stoffe aus dem Blut in den Liquor übertreten können. Umgekehrt kann sie giftige Substanzen aus dem Nervenwasser heraustransportieren und damit entsorgen.
Beim Subtyp 4 von Alzheimer könnte die Entsorgung der Amyloide behindert sein – also jener Stoffe, aus denen die Alzheimer-Plaques bestehen.
Nach Ansicht von Tijms gibt es aber auch einen möglichen Ansatzpunkt für eine Therapie: Bei diesem Subtyp werden bestimmte Immunzellen (Monozyten und T-Zellen) angelockt. Möglicherweise ließe sich hier medikamentös eingreifen.
Subtyp 5 (Funktionsstörung der Blut-Hirn-Schranke)
Subtyp 5 betraf in der Studie 13,4 Prozent der Untersuchten Alzheimer-Patientinnen und -Patienten. Bei ihnen ist die Funktion der sogenannten Blut-Hirn-Schranke gestört:
Diese lässt normalerweise nur bestimmte Stoffe aus dem Blut ins Gehirn übertreten. Somit schützt sie das Gehirn vor Giftstoffen und Krankheitserregern, die im Blut zirkulieren.
Bei den Alzheimererkrankten vom Subtyp 5 waren die Konzentrationen verschiedener Eiweiße im Blut auffällig erhöht. Betroffen waren unter anderem Blutproteine wie Albumin, Fibrinogen und Prothrombin sowie verschiedene Antikörper (Immunglobuline) wie IgG1.
Versagt die Blut-Hirn-Schranke, könnten diese Eiweiße ins Gehirn vordringen. Die erhöhten Eiweißwerte stehen beispielsweise im Zusammenhang mit der Blutgerinnung und entzündlichen Prozessen.
Personalisierte Medizin
Die neuen Erkenntnisse könnten helfen, Alzheimerbetroffene künftig gezielter zu behandeln.
Diese Ergebnisse weisen auf molekulare Unterschiede bei Alzheimerdemenz hin. Sie verdeutlichen die Notwendigkeit einer personalisierten Medizin
Fazit der Forschenden um Betty Tijms

Auch interessant
Welche Vorteile bietet die PKV gegenüber der GKV?
Privatvollversicherte profitieren von einem besonders umfassenden Gesundheitsschutz, der viele Vorteile bietet. Sie erhalten oftmals schneller...
WeiterlesenWann ist eine Zahnzusatzversicherung sinnvoll?
Gesunde Zähne sind zentral für unser Wohlbefinden, Aussehen und Gesundheit. Oft merkt man das jedoch erst, wenn erste Probleme auftreten. Eine...
WeiterlesenWann ist die private Krankenversicherung für Ärzte sinnvoll?
Mediziner wissen, wie wichtig eine gute medizinische Versorgung im Krankheitsfall ist. Wer täglich für die Gesundheit anderer sorgt, sollte auch...
Weiterlesen
















